“Base imprescindibile di biochimica, bioenergetica e fisiologia è un’ alimentazione bilanciata h 24 più una eventuale integrazione di AAE in corretto rapporto tra loro per le necessità umane (F. S. Dioguardi, 2008) che assicura un EQUILIBRIO NEL SANGUE per una accresciuta SINTESI PROTEICA (Kraemer JW, Volek JS, Dioguardi FS et al., Metabolism 2006).“
E’ ormai una EBM (Evidence Based Medicine) soprattutto per gli atleti tendenzialmente con bassa percentuale di grasso, elevati dispendi calorici e rischi di “crisi” del sistema immunitario e di sindrome da sovrallenamento (malnutrizione relativa dell’atleta). Anche se molti allenatori e scienziati sembrano ancora ignorare questo.
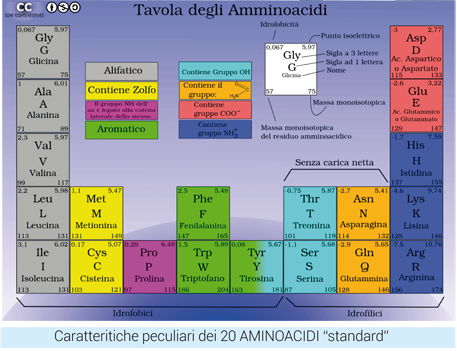
Gli AMINOACIDI non sono tutti uguali (nemmeno quelli ESSENZIALI lo sono) e questo è un punto chiave per comprendere la migliore integrazione possibile, ovvero una supplementazione più “funzionale” come oggi va molto di moda dire… Una miscela di uguale quantità ma di AA diversi provoca effetti diversi con risposte organiche anche completamente diverse (per esempio sulla glicemia). Per esempio integrare con OVOALBUMINA o con miscele di aminoacidi dalla formulazione/composizione simile determina una attività metabolica antagonista all’insulina sulle cellule periferiche (perché contengono troppa ALANINA e ARGININA) quindi una scarsa efficacia su muscoli, cuore, fegato) (Krebs M et al., Diabetes 2002; Solerte SB et al., Am J Cardiol 2008; Young VR e Bier DM, J Nutr 1987; Millward DJ e Rivers JPW, Eur J Clin Nutr 1988).
L’assunzione di un singolo aminoacido (come di una singola vitamina o di un singolo minerale) non è mai una scelta azzeccata, a meno che ne sia stata verificata la carenza.
ALANINA e ARGININA assunte oralmente come singoli aminoacidi provocano resistenza periferica all’insulina, con un decremento dell’efficacia metabolica ed in particolare della produzione/azione dell’ossido nitrico (ON oppure NO) con effetto vaso-costrittivo e probabilità di crampi (l’esatto contrario di quello che si va teoricamente ricercando con questa integrazione…).
Semplificando molto (ce ne scusino i biochimici…) ARGININA ed ALANINA assunte come integratori rendono l’insulina meno efficace a livello metabolico sui vari tessuti, in primis il muscolo.
Invece l’assunzione di una corretta miscela di AAE permette una continua conversione della CITRULLINA in ARGININA (abbiamo sintetizzato molto: il quadro biochimico e metabolico che si innesca è ben più complesso, ma non è oggetto di questa trattazione) con produzione di Ossido Nitrico dove serve (endotelio) con effetto di vasodilatazione e scambi “locali” migliorati.
Quindi solo un adeguato apporto di AAE può garantire realmente una condizione di disponibilità di ARGININA e di ossidi di azoto (ON) dove serve realmente (endotelio dei piccoli vasi, piastrine): glucosio e AA devono entrare senza sforzo nel CICLO DELL’ACIDO CITRICO (TCA o Ciclo di Krebs o Ciclo degli Acidi Tricarbossilici) per mantenerlo efficiente (anaplerotico) come ‘’esportatore’’ di varie sostanze (intermedi) che fanno funzionare il tutto fisiologicamente (Gli aminoacidi: lettere di un alfabeto più antico della vita, F. S. Dioguardi, 2008).
L’ARGININA è quindi un aminoacido interessante e complesso, complessità metabolica evidente anche in letteratura: efficace in alcune situazioni patologiche
(per es. immunostimolazione del paziente malnutrito) e negativa in altre situazioni metaboliche (soggetti infartuati) (Ligthart-Melis G.C., Am J Clin Nutr 2008).
Ribadiamo come sia appurato il suo ruolo chiave come precursore dell’Ossido di Azoto (NO) portando a vasodilatazione; il problema metabolico è che questo aminoacido è anche il principale stimolo alla secrezione di ormoni antagonisti all’insulina: Glucagone e GH. 
Sembra un controsenso perché negli studi controllati con ARGININA assunta per bocca i risultati sono negativi nonostante il teorico effetto vasodilatatore ON mediato. Semplicemente perché i rapporti biochimico-metabolici tra queste molecole sono molto complessi (Bredt D.S. e Snyder S.H., Annu Rev Biochem 1994; Alvestrand A. e Bergstrom J, The Lancet 1984; Ohneda A. et al., J Clin Invest 1968; Bode-Boger S.M. et al., Vasc Med 2003).
E’ la produzione “locale” di ARGININA che risulta fondamentale e dipende dalla possibilità della CITRULLINA
di essere rapidamente e copiosamente trasformata in ARGININA e questo dipende, più che dalla quantità di ARGININA assunta, dallo “stato” metabolico del Ciclo di Krebs (TCA) quando sia efficacemente “alimentato” da glucosio o aminoacidi per “esportare” ASPARTATO, che a sua volta attiva enzimi sequenziali e specifici per la continua resintesi di ARGININA dalla CITRULLINA (Freedman J.E. et al., J Clin Invest 1997; Morris S.M. jr., Am J Clin Nutr 2006).
Ancora una volta solo la disponibilità continua di AAE mantiene rifornito di “intermedi” il Ciclo degli Acidi Tricarbossilici (TCA) anche nel caso di “interruzione” di molecole provenienti dalla glicolisi (carenza di glucosio, carboidrati). Si può ottenere così quella che è definita “ZONAZIONE DELLA SINTESI”: il TCA efficiente e alimentato da molecole adatte può fare in modo di sintetizzare ARGININA nei tessuti dove viene consumata (endotelio e piastrine che possono gestire autonomamente il fenomeno interagendo e regolando la produzione necessaria di ON) (Gli aminoacidi: lettere di un alfabeto più antico della vita, F. S. Dioguardi, 2008).

Se invece si innesca metabolicamente una eccessiva β-ossidazione (carenza di glucosio, mancanza di intermedi amminoacidici) viene a mancare l’esportazione di Aspartato dal TCA e tutta la sequenza metabolica efficace si ferma… Utile ricordare che solo il FEGATO, e non il MUSCOLO, è capace d sintetizzare nuovo glucosio a partire dagli aminoacidi del plasma o “smontando” proteine circolanti (NEO-GLUCOGENESI): la glicemia dipende dal fegato. L’ALANINA è dannosa per la glicolisi perché concorre con il piruvato a livello dei carrier specifici (trasportatori) per l’entrata nei mitocondri ed è anche uno stimolante per la NEOGLUCOGENESI.
In patologie come diabete e insufficienza cardiaca si consumano tanti AA a scopo energetico: questi soggetti presentano un marcato catabolismo della muscolatura scheletrica. Gli AA vanno incontro a catabolismo (in modo diverso rispetto alla loro formula chimica) entrando nei MITOCONDRI per gradiente di concentrazione. Il numero di “variabili metaboliche” implicate nei processi qui sommariamente descritti è enorme: interazioni infinite tra glucosio, acidi grassi, e i 20 aminoacidi… intermedi, enzimi, coenzimi. 
Non esiste un “modello matematico” in grado di considerarle tutte fornendo previsioni soddisfacenti (l’equazione avrebbe ben più di 10 incognite… irrisolvibile!), anche se alcuni scienziati ci hanno provato (Millward D.J. e Rivers J.P.W., Eur J Clin Nutr 1988; Taegtmayer H, Curr Prob Cardiol 1994).
Interessante soluzione è stata quella di formare gruppi di AA selezionandoli in base all’ “INTERMEDIO” del loro catabolismo e come questo interferisca metabolicamente (reazione predominante) con la produzione energetica da grassi e/o carboidrati: è quello che è stato fatto per realizzare miscele amminoacidiche più adatte al metabolismo umano (cluster) (F. S. Dioguardi,
2008-2017).

Un “CLUSTER OF AMINOACIDS TAILORED ON HUMAN NEEDS” deve tenere conto delle necessità energetiche e di quelle sintetiche: controllare una eccessiva β-ossidazione ma mantenere una efficiente produzione energetica permettendo le sintesi (ad esempio NutriXam® by Mytho).
Una integrazione amminoacidica efficace deve avere tre requisiti. TANTI, SPESSO, BUONI (AAE ben formulati). In generale per gli ATLETI 5-8 grammi 3-4 volte al giorno (da 15-20 g a 25-35 g).
Quindi una integrazione costosa e impegnativa.
Eventualmente una integrazione “minimale” circoscritta all’allenamento: 5 g 30’ prima e 5 g nelle 3 ore successive (F. S. Dioguardi, 2008). Essenziale anche mantenere una ottimale idratazione: gli AA entrano nelle cellule per gradiente di concentrazione, da dove ce ne sono molti (sangue) a dove ce ne sono pochi (muscoli). Anche all’interno della cellula lo stesso, passano per gradiente di concentrazione dal citoplasma (tanti) al mitocondrio (pochi) (Woolfson AMJ, Proc Nutr Soc 1983).
Assumere molte proteine alimentari non sempre serve o non sempre è possibile: se è necessario un controllo calorico o un mantenimento del peso corporeo con bassa percentuale di grasso, è difficile seguire una alimentazione equilibrata in carboidrati e grassi e contemporaneamente introdurre aminoacidi sufficienti tramite le proteine del cibo.
 Da non dimenticare che queste ultime contengono una percentuale dei 5 AAE che coprono il 75% del
Da non dimenticare che queste ultime contengono una percentuale dei 5 AAE che coprono il 75% del
nostro fabbisogno di azoto molto piccola, inferiore al 16%. O si introducono tante calorie (e anche tanti AA NON essenziali) o si rischia una sorta di ‘’malnutrizione’’ muscolare celata (nell’atleta). Per esempio l’ISTIDINA è presente in piccole quantità nelle proteine alimentari (ed anche in forma modificata, poco utilizzabile a livello muscolare) ma è indispensabile per formare la GLOBINA (insieme ad altri AA) ovvero la struttura che mantiene il ferro eme al suo centro (emoglobina).
Allenarsi intensamente a digiuno 2-3 volte a settimana, magari al mattino soprattutto per atleti delle discipline di endurance, è un ‘’trucco’’ magnifico per rendere il fegato allenato a trasformare aminoacidi in glucosio, aumentando il corredo enzimatico che sottintende efficacemente a questa via metabolica, ma gli aminoacidi bisogna che siano disponibili… (F. S. Dioguardi, 2008).
aminoacidi in glucosio, aumentando il corredo enzimatico che sottintende efficacemente a questa via metabolica, ma gli aminoacidi bisogna che siano disponibili… (F. S. Dioguardi, 2008).
Sembra impossibile ma la “malnutrizione”, intesa come perdita di massa muscolare/magra da parte di atleti evoluti con intenso training giornaliero, è un aspetto tutt’altro che trascurabile o poco diffuso ed è dimostrata la sua correlazione con un peggiore livello di performance anche rimanendo nell’eccellenza prestativa così come è verificato che la malnutrizione proteico-calorica diviene un problema medico centrale per la sopravvivenza di soggetti patologici (Argiles J.M., European Journal of Oncology Nursing, 2005).
LA MISCELA IDEALE da assumere contiene tutti gli aminoacidi essenziali: si permette così al fegato di costruire partendo da questi tutti quelli che si rendano necessari all’organismo. Ripetiamo ancora come 5 aminoacidi da soli coprano il 75% delle necessità organiche ma gli stessi sono contenuti in quantità piccole negli alimenti proteici, anche i più ricchi e selezionati nel caso di alimentazioni iperproteiche (meno del 20%). Alcuni AAE non sono indispensabili per il metabolismo generale, ma lo diventano per certi organi in particolare: solo il fegato ad esempio può trasformare la FENILALANINA in TIROSINA per azione di una idrossilasi (enzima) non presente a livello cellulare in altri tessuti (muscolo) dove potrebbe divenire “aminoacido limitante” per le sintesi.

Anche alcuni AMINOACIDI NON ESSENZIALI possono essere molto utili nelle giuste quantità e in corretto rapporto con gli AAE per le reali necessità metaboliche umane.
La METIONINA (aminoacido solforato) è essenziale per molti processi metabolici ma si trasforma in OMOCISTEINA (una sostanza potenzialmente tossica per l’uomo che se si accumula nel sangue può causare aterosclerosi) in concomitanza ad una carenza vitaminica (B12 o Cobalamina e Acido Folico o B9) oppure quando in un alimento o in un integratore amminoacidico sia presente in assenza di suffi ciente CISTEINA che da questo punto di vista metabolico diviene un “aminoacido protettivo” (o “semi-indispensabile” o “semiessenziale”).
Ecco spiegato con un esempio “metabolico” come un integratore amminoacidico ideale non debba fornire solo materiale plastico per le sintesi potenziali (es. METIONINA) ma anche prevenire possibili squilibri metabolici dovuti ad accumulo/ assunzione di molecole non utilizzabili dall’organismo. Contenere ad es. CISTEINA in giusta dose: in un rapporto almeno doppio rispetto alla METIONINA (The HOPE 2 Investigators, N Engl J Med 2006) anche se questo aminoacido compare nella colonna “AA NON ESSENZIALI” quasi in ogni tabella di classifi cazione (F. S. Dioguardi, 2008).
Gli aminoacidi nel loro complesso sono poco solubili ed occorre tanta acqua per mantenerli sciolti: le miscele pure devono essere proposte in compresse/capsule per essere utilizzate al meglio per via orale.
Tra le varie CLASSIFICAZIONI proposte per gli AA, dipendenti dal parametro scelto per realizzarle (caratteristiche chimico fisiche, polarità, presenza del gruppo carbossilico e/o amminico) quella “FUNZIONALE o FINALISTA”
(Gli aminoacidi: lettere di un alfabeto più antico della vita, F. S. Dioguardi, 2008) che li divide secondo il loro destino metabolico finale sembra quella più utile per formulare una miscela “metabolicamente logica adatta all’integrazione umana”.
Tiene conto essenzialmente di come gli AA possono essere utilizzati dall’organismo per fare GLUCOSIO (o suoi intermedi) oppure per fare LPIDI: in defi nitiva AA GUCOGENICI, CHETOGENICI o MISTI.
I  CHETOGENICI puri sono 2 (Leucina e Lisina) perché danno alla fine del loro metabolismo AcetilCoA o AcetoAcetilCoA, che nell’uomo non può più essere riconvertito in glucosio; i MISTI che danno sia precursori del glucosio sia AcetilCoA sono 5 (Isoleucina, Fenilalanina, Treonina, Triptofano e Tirosina); gli altri 13 AA sono GLUCOGENICI: alcuni originano piruvato (quindi mezza molecola di glucosio) al termine del loro catabolismo (Alanina, Cisteina, Glicina, Serina) mentre altri producono Ossalacetato, Succinato e altri importanti intermedi del ciclo di Krebs (TCA).
CHETOGENICI puri sono 2 (Leucina e Lisina) perché danno alla fine del loro metabolismo AcetilCoA o AcetoAcetilCoA, che nell’uomo non può più essere riconvertito in glucosio; i MISTI che danno sia precursori del glucosio sia AcetilCoA sono 5 (Isoleucina, Fenilalanina, Treonina, Triptofano e Tirosina); gli altri 13 AA sono GLUCOGENICI: alcuni originano piruvato (quindi mezza molecola di glucosio) al termine del loro catabolismo (Alanina, Cisteina, Glicina, Serina) mentre altri producono Ossalacetato, Succinato e altri importanti intermedi del ciclo di Krebs (TCA).
Questi ultimi sono quindi utilizzabili al posto del glucosio per produrre energia ma anche per dare OSSALACETATO in modo indipendente da quello derivato dal glucosio/piruvato, in definitiva come fini “regolatori” del complesso e primordiale metabolismo mitocondriale (mitocondri: archeo-batteri saprofiti obbligati presenti solo nell’ovulo materno). Non si deve mai dimenticare come nell’atleta o nel soggetto sportivo in situazioni di sovrallenamento e catabolismo muscolare gli AA vengano consumati a scopo energetico: se i consumi superano di molto l’approvvigionamento calorico si instaura perdita di massa muscolare e solo molto dopo catabolismo a carico delle riserve di grasso.
L’integrazione con una buona miscela amminoacidica, funzionalmente assemblata sulle richieste metaboliche umane quindi con un rapporto quantitativo-qualitativo ideale fra AA chetogenici e misti, permette di realizzare il giusto compromesso fra OSSIDAZIONE, GLICOLISI e SINTESI (Gli aminoacidi: lettere di un alfabeto più antico della vita, F. S. Dioguardi, 2008).
(continua)


di Stefano Zambelli – MFS – M.Sc. Direttore Tecnico ISSA Europe
Desideri leggere tutti gli articoli presenti nella rivista e riceverne una copia cartacea a casa?
Se sei un nuovo utente, REGISTRATI sul sito e acquista l’Abbonamento!
oppure
Se sei già un utente registrato, EFFETTUA IL LOGIN e rinnova il tuo Abbonamento alla Rivista!
Inoltre, una volta che ti sarai REGISTRATO, avrai la possibilità di partecipare alla CONVENTION ISSA e Iscriverti ai nostri CORSI e SEMINARI!